Phân tích chi tiết về phản ứng giữa KHSO4 và NaHCO3: Ứng dụng trong giảng dạy và thực tiễn
Giới thiệu tổng quan
Trong hóa học, phản ứng giữa Kali hydro sulfat (KHSO4) và Natri hydro carbonat (NaHCO3) là một ví dụ điển hình về phản ứng trao đổi ion và giải phóng khí. Bài viết này sẽ phân tích chi tiết về bản chất, cơ chế và ứng dụng của phản ứng này trong giáo dục và đời sống.

Bản chất hóa học của các chất tham gia phản ứng
Kali hydro sulfat (KHSO4)
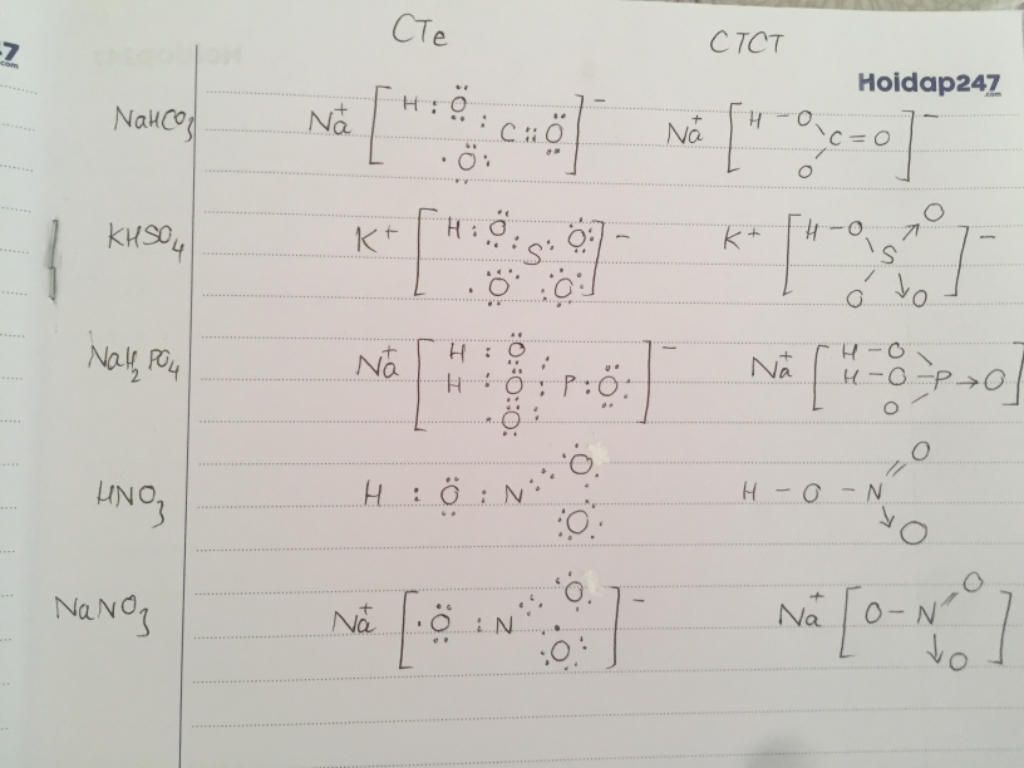
- Công thức phân tử: KHSO4
- Cấu tạo: Gồm ion K+ và ion HSO4-
- Tính chất vật lý:
- Là chất rắn màu trắng
- Tan tốt trong nước
- Có tính axit
- Tính chất hóa học: Là một muối axit, có khả năng phản ứng với bazơ và muối của axit yếu hơn
Natri hydro carbonat (NaHCO3)
- Công thức phân tử: NaHCO3
- Tên thường gọi: Baking soda
- Cấu tạo: Gồm ion Na+ và ion HCO3-
- Tính chất vật lý:
- Là chất rắn màu trắng
- Tan được trong nước
- Có tính bazơ yếu
- Ứng dụng phổ biến trong đời sống như làm bánh, làm sạch…
Phân tích phản ứng hóa học
Phương trình phản ứng
KHSO4 + NaHCO3 → K2SO4 + Na2SO4 + H2O + CO2↑
Cơ chế phản ứng
- Giai đoạn 1: Các chất tan trong nước và điện ly
- KHSO4 → K+ + HSO4-
- NaHCO3 → Na+ + HCO3-
- Giai đoạn 2: Phản ứng trao đổi proton
- HSO4- + HCO3- → SO42- + H2CO3
- Giai đoạn 3: Phân hủy axit carbonic
- H2CO3 → H2O + CO2↑
Ứng dụng trong giảng dạy và thực hành
Trong phòng thí nghiệm
- Thí nghiệm minh họa:
- Chuẩn bị dung dịch KHSO4 và NaHCO3
- Trộn hai dung dịch
- Quan sát sự tạo bọt khí CO2
- Kiểm tra tính chất của khí tạo thành
- Các kỹ năng thực hành:
- Kỹ năng pha chế dung dịch
- Kỹ năng quan sát hiện tượng
- Kỹ năng ghi chép và phân tích số liệu
Trong giảng dạy
- Minh họa các khái niệm:
- Phản ứng trao đổi ion
- Cân bằng phương trình hóa học
- Tính toán định lượng
- Phương pháp giảng dạy:
- Kết hợp lý thuyết và thực hành
- Sử dụng phương pháp trực quan
- Tăng cường tương tác với học sinh
Ứng dụng thực tiễn
Trong công nghiệp
- Sản xuất các sản phẩm làm sạch
- Quy trình xử lý nước thải
- Sản xuất các chất phụ gia thực phẩm
Trong đời sống
- Làm bánh và chế biến thực phẩm
- Vệ sinh và tẩy rửa
- Xử lý môi trường

Lưu ý an toàn khi thực hiện phản ứng
Các biện pháp phòng ngừa
- Sử dụng thiết bị bảo hộ cá nhân
- Thao tác trong điều kiện thông thoáng
- Tuân thủ quy trình an toàn phòng thí nghiệm
Xử lý sự cố
- Quy trình xử lý khi có tràn đổ hóa chất
- Sơ cứu khi tiếp xúc với hóa chất
- Số điện thoại khẩn cấp cần thiết
Kết luận
Phản ứng giữa KHSO4 và NaHCO3 là một ví dụ điển hình trong giảng dạy hóa học, giúp học sinh hiểu rõ về phản ứng trao đổi ion và ứng dụng của chúng trong đời sống. Việc nắm vững kiến thức này sẽ giúp học sinh phát triển tư duy khoa học và kỹ năng thực hành.
Để cập nhật thêm các thông tin mới nhất về giáo dục và khoa học, vui lòng truy cập Website Giáo Dục – Nơi chia sẻ kiến thức, kinh nghiệm và tài liệu giáo dục chất lượng cao.
Thông tin liên hệ:
- Hotline: 0901 02 03 04
- Email: [email protected]
- Website: websitegiaoduc.com
Bài viết được tổng hợp và biên soạn bởi đội ngũ chuyên gia giáo dục, nhằm mục đích hỗ trợ giáo viên và học sinh trong quá trình dạy và học môn Hóa học.












0 Comment